| Methode |
| |
Synonym |
|
FTA-ABS
|
 |
Englisch |
|
Fluorescent Treponema Antibody Absorbent Test
|
 |
OPSI |
|
|
 |
Methode |
|
Prinzip der indirekte Immunfluoreszenz:
Patientenseren werden in Sorbent verdünnt, um unspezifische Antikörper zu entfernen. Die absorbierten Proben werden auf das Treponema-pallidum-Antigen aufgetragen und inkubiert. Sind spezifische Antikörper vorhanden, findet eine Antigen-Antikörper-Reaktion statt. Dieser Komplex bindet Fluoreszein-markiertes Antihuman-γ-Globulin. Die daraus resultierende Reaktion zeigt eine leuchtende grüne Fluoreszenz der Treponemen.
|
 |
Geschichte |
|
|
 |
|
| |
| Indikationen |
| |
Indikationen |
|
Treponemen-Nachweis zur Lues- oder Lues connata-Diagnostik
|
 |
|
| |
| Durchführung |
| |
Vorbereitung |
|
- Wasserbad auf 56°C und Brutschrank auf 37°C stellen
- Vor Gebrauch alle Testkomponenten auf Raumtemperatur bringen
- Reaktives Kontrollserum (Lyophilisat) mit 1,0 ml A.dest. rekonstituieren
- Unspezifisches Kontrollserum (Lyophilisat) mit 1,0 ml A. dest. rekonstituieren
- Patienten- und Kontrollseren 30 min. im Wasserbad inaktivieren (bereits inaktivierte Seren noch mal 10 min. inaktivieren)
- PBS-Puffer herstellen; dazu Inhalt eines Tütchens in 1000 ml A. dest. lösen
- FITC-Konjugat (= Antihuman-Immunglobulin von Ziege; Lyophilisat) in 3 ml A.dest rekonstituieren und 10-15 min. auf dem Rüttler auflösen
- Sorbent ist gebrauchsfertig
- Objektträger erst nach dem Temperieren öffnen; Druck auf Testfelder vermeiden
- Reaktives Kontrollserum 1:5 mit PBS ansetzen: 10 μl reaktives KO-Serum + 40 μl PBS
- Reaktives Kontrollserum 1:5 mit Sorbent ansetzen: 10 μl reaktives KO-Serum + 40 μl Sorbent
- Minimal (1+) reaktives Kontrollserum ansetzen (Titer aufgedruckt) 1:500: 10 μl reaktives KO-Serum + 4990 μl PBS
- Unspezifisches Kontrollserum 1:5 mit PBS ansetzen:
10 μl unspez. KO-Serum + 40 μl PBS
- Unspezifisches Kontrollserum 1:5 mit Sorbent ansetzen:
10 μl unspez. KO-Serum + 40 μl Sorbent
- Patientenseren 1:5 mit Sorbent verdünnen:
10 μl Pat.-Serum + 40 μl Sorbent
|
 |
Pipettierschema |
|
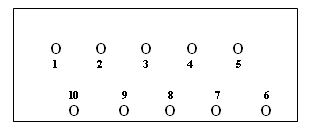
|
 |
Durchführung |
|
- Kavität 1: 10 μl Reaktives Kontrollserum 1:5 mit PBS
Kavität 2: 10 μl Reaktives Kontrollserum 1:5 mit Sorbent
Kavität 3 : 10 μl Minimal (1+) reaktives Kontrollserum
Kavität 4 : 10 μl Unspezifisches Kontrollserum 1:5 mit PBS
Kavität 5: 10 μl Unspezifisches Kontrollserum 1:5 mit Sorbent
Kavität 6: 10 μl PBS-Puffer (Reagenzkontrolle)
Kavität 7: 10 μl Sorbent (Reagenzkontrolle)
Kavität 8: 10 μl Patientenserum
Kavität 9: 10 μl Patientenserum
Kavität 10: 10 μl Patientenserum
Achtung: Alle Testfelder müssen vollständig bedeckt sein! Testfelder nicht mit Pipettenspitze berühren! Kreuzkontamination zwischen einzelnen Auftragsstellen vermeiden!
- Inkubation: 30 min. bei 37°C in feuchter Kammer
- Spülen: Objektträger vorsichtig mit PBS abspülen; Flüssigkeitsstrahl nicht direkt auf Testfelder richten; Verschleppung von Serum auf andere Testfelder vermeiden
- 2 x 10 min. Objektträger in einem Färbetrog mit PBS waschen. Vorsichtig auf dem Rüttler bewegen. Puffer zwischendurch wechseln.
- Objektträger vorsichtig mit A. dest. abspülen
- Trocknen: Objektträger mit der Kante aufstoßen, Maske mit Papier trockenen, Lufttrocknen. Objektträger müssen vollständig trocken sein.
- Konjugat: 10 μl auf jedes Feld auftragen
- Inkubation: 30 min. bei 37°C in feuchter Kammer im Brutschrank (dunkel) inkubieren
- Arbeitsschritte 3 bis 6 wiederholen
- Eindecken: einen kleinen Tropfen Eindeckmedium auf jedes 2. Testfeld geben und vorsichtig ein Deckglas auflegen; Luftblasen vermeiden
- Lagerung: Bis zur mikroskopischen Beurteilung (max. 4 h) dunkel lagern. Austrocknung vermeiden.
- Ablesen:
- Die Beurteilung der Objektträger sollte in einem dunklen Raum stattfinden
- Testfelder mit nichtreaktiven Ergebnissen müssen im Dunkelfeld auf das Vorhandensein von Treponemen untersucht werden.
- Als Ablesestandard dient die minimal (1+) reaktive Kontrolle. Die Fluoreszenz aller Kontrollen und Patientenseren nach folgendem Schema protokollieren:
- 4+ sehr starke Fluoreszenz -> reaktiv
- 3+ starke Fluoreszenz -> reaktiv
- 2+ mäßige Fluoreszenz -> reaktiv
- 1+ schwache Fluoreszenz, entsprechend minimal-KO -> reaktiv
- <1+ schwächere Fluoreszenz als minimal-KO -> grenzwertig
- keine oder kaum wahrnehmbar Fluoreszenz -> nichtreaktiv
|
 |
| |
| Messungen |
| |
Meßfehler |
|
Bei der Testvorbereitung:
- Nur Serum verwenden, kein Plasma
- Keine stark lipämischen oder hämolytischen Seren verwenden
- Vor Gebrauch alle Reagenzien auf Raumtemperatur bringen
- Serumverdünnung gut mischen
Bei der Testdurchführung:
- Angegebene Inkubationszeiten sind strikt einzuhalten
- Brutschrank auf Soll-/Ist-Temperatur überprüfen
- Spül- und Waschvorgänge mit Puffer sind vorsichtig durchzuführen, da sonst eine Kontamination der negativen Seren durch positive möglich ist oder die Antigene durch zu starkes Spülen von der Platte abgelöst werden können
- Beim Eindecken der trockenen Präparate nur wenig Eindeckmittel verwenden, da sonst das Deckglas nicht richtig haftet.
- Deckglas langsam auflegen, um Blasenbildung zu vermeiden
- Lagerung der Präparate im Dunkeln (über Nacht: im Kühlschrank)
- Im Kühlschrank gelagerte Präparate sind vor der Auswertung auf Zimmertemperatur zu bringen (ca. 10 min.)
- Die Präparate können durch zu lange Erregerbestrahlung vorzeitig ausbleichen.
Bei der Testauswertung:
- Die Negativ-Kontrollen weisen Fluoreszenz auf: Ist eine Kontamination mit benachbarten Proben erfolgt?
Waren die Waschvolumina zu gering ?
|
 |
Interpretation |
|
|
 |
|
| |
| Nebenwirkungen und Komplikationen |
| |
|
|
|
 |
|
| |
| Kontraindikationen |
| |
|
|
|
 |
|
| |
| Bewertung |
| |
Bewertung |
|
Der FTA-ABS weist Antikörper gegen Treponemen mit Hilfe von Treponemen nach. Er ist somit spezifischer als Tests ohne Treponemen (wie VDRL), mit denen man Reagine nachweist, die auch durch andere Krankheiten entstehen können. Zusätzlich werden unspezifische Reaktionen durch Inkubation des Patientenserums mit Reiter-Treponemen verhindert.
Der FTA-ABS dient als Bestätigungstest, wenn der Suchtest (TPPA) positiv ist.
|
 |
|
| |
| Referenzen |
| |
Lehrbuch |
|
|
 |
Reviews |
|
|
 |
Studien |
|
|
 |
Links |
|
|
 |
Adressen |
|
|
 |
| |
| Editorial |
| |
Autor |
|
Sabine Petersdorf
|
 |
Erstellt |
|
04.12.2004
|
 |
Reviewer |
|
|
 |
Linker |
|
|
 |
Status |
|
TRACK3
|
 |
Licence |
|
Lizenz für freie Inhalte
|
 |
| |
| Kommentare |
| |
 |
| |




























