Durchführung |
|
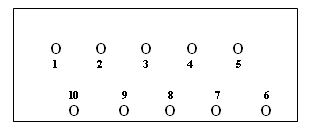
- Kavität 1: 10 μl Reaktives Kontrollserum 1:5 mit PBS
Kavität 2: 10 μl Reaktives Kontrollserum 1:5 mit Sorbent
Kavität 3 : 10 μl Minimal (1+) reaktives Kontrollserum
Kavität 4 : 10 μl Unspezifisches Kontrollserum 1:5 mit PBS
Kavität 5: 10 μl Unspezifisches Kontrollserum 1:5 mit Sorbent
Kavität 6: 10 μl PBS-Puffer (Reagenzkontrolle)
Kavität 7: 10 μl Sorbent (Reagenzkontrolle)
Kavität 8: 10 μl Patientenserum
Kavität 9: 10 μl Patientenserum
Kavität 10: 10 μl Patientenserum
Achtung: Alle Testfelder müssen vollständig bedeckt sein! Testfelder nicht mit Pipettenspitze berühren! Kreuzkontamination zwischen einzelnen Auftragsstellen vermeiden!
- Inkubation: 30 min. bei 37°C in feuchter Kammer
- Spülen: Objektträger vorsichtig mit PBS abspülen; Flüssigkeitsstrahl nicht direkt auf Testfelder richten; Verschleppung von Serum auf andere Testfelder vermeiden
- 2 x 10 min. Objektträger in einem Färbetrog mit PBS waschen. Vorsichtig auf dem Rüttler bewegen. Puffer zwischendurch wechseln.
- Objektträger vorsichtig mit A. dest. abspülen
- Trocknen: Objektträger mit der Kante aufstoßen, Maske mit Papier trockenen, Lufttrocknen. Objektträger müssen vollständig trocken sein.
- Konjugat: 10 μl auf jedes Feld auftragen
- Inkubation: 30 min. bei 37°C in feuchter Kammer im Brutschrank (dunkel) inkubieren
- Arbeitsschritte 3 bis 6 wiederholen
- Eindecken: einen kleinen Tropfen Eindeckmedium auf jedes 2. Testfeld geben und vorsichtig ein Deckglas auflegen; Luftblasen vermeiden
- Lagerung: Bis zur mikroskopischen Beurteilung (max. 4 h) dunkel lagern. Austrocknung vermeiden.
- Ablesen:
- Die Beurteilung der Objektträger sollte in einem dunklen Raum stattfinden
- Testfelder mit nichtreaktiven Ergebnissen müssen im Dunkelfeld auf das Vorhandensein von Treponemen untersucht werden.
- Als Ablesestandard dient die minimal (1+) reaktive Kontrolle. Die Fluoreszenz aller Kontrollen und Patientenseren nach folgendem Schema protokollieren:
- 4+ sehr starke Fluoreszenz -> reaktiv
- 3+ starke Fluoreszenz -> reaktiv
- 2+ mäßige Fluoreszenz -> reaktiv
- 1+ schwache Fluoreszenz, entsprechend minimal-KO -> reaktiv
- <1+ schwächere Fluoreszenz als minimal-KO -> grenzwertig
- keine oder kaum wahrnehmbar Fluoreszenz -> nichtreaktiv
|