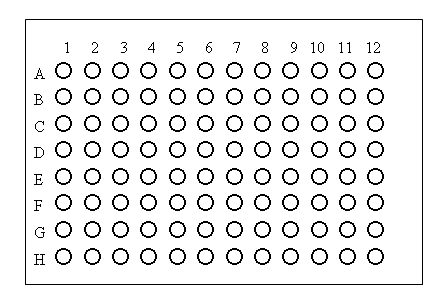
Durchführung |
|
- 25 μl VP vorlegen: 1./3./4./5./6. Delle einer jeden Reihe und in alle 4 Komplement-KO
- 25 μl pos. KO-Serum in 1./2./3. Delle der 1. Reihe
25 μl neg. KO-Serum in 1./2./3. Delle der 2. Reihe
25 μl Pat.-Serum in 1./2./3. Delle der 3. Reihe
Verdünnungsreihe anlegen: je 25 μl übertragen von 3.->4.-> 5.->6. /` 25 μl verwerfen
bei jeder Reihe gleich verfahren
- 25 μl verdünntes AG (1:120 ) in 2.-6. Delle in allen Reihen und in alle Komplement-KO
- 25 μl Komplement-Verdünnung (2E) in alle Dellen ( pos.KO, neg.KO, SerumKO und Pat.)
- 25 μl Komplement-Verdünnung ( 1,5/ 1,0/ 0,5E) in entsprechende Delle der Komplement-KO
- Rüttler: 10 sek. schütteln
- Inkubation: 60 min. bei 37°C abgedeckt im Brutschrank
- Ambozeptor-Gebrauchsverdünnung herstellen 1:25 60 μl Stammlösung + 1440 μl VP
- Hämolytisches System ansetzen ( für eine Platte )
1,5 μl Ambozeptor + 1,5 μl Erythrozyten ( 1%, gebrauchsfertig, gut mischen)
Mischung schwenken (Erys gehen beim Schütteln kaputt!) und 15 min. bei 37°C inkubieren
( = sensibilisieren)
- 50 μl hämolyt. System in alle Dellen pipettieren
- Rüttler: 10 sek. schütteln
- Inkubation: 30 min. bei 37°C zugedeckt im Brutschrank (alle 10 min. rütteln)
- Rüttler: 10 sek. schütteln
- Zentrifugieren: 5 min. bei 2000 U/min.
- Ablesen:
positiv: Sedimentierung der Erys (Knopfbildung )
negativ: vollständige Hämolyse der Erys ("klar")
Serum-Kontrolle: muß immer negativ sein, da sie kein Antigen enthält!
Ist sie doch positiv, gilt das Serum als antikomplementär,d.h. falsch positiv! Das Ergebnis dieser Probe darf nicht bewertet werden!
pos. KO: muß vorab bestimmten Titer aufweisen ( z.B. 1:40 )
neg. KO: muß negativ sein
Patienten-Seren: als Titer wird die höchste Verdünnung angegeben, bei der es noch zu einer deutlichen Knopfbildung (= Hemmung der Hämolyse ) kommt. Erfolgt überhaupt keine Knopfbildung, hat der Patient keine Antikörper
Komplement-KO:
- 2,0E: vollständige Hämolyse
- 1,5E: vollständige Hämolyse
- 1,0E: Hemmung der Hämolyse
- 0,5E: Agglutination ( Knopf )
1 Einheit Komplement reicht, um alle Erys des Testsystems zu hämolysieren
|